FIFARMA lanza la segunda versión del informe W.A.I.T Indicator que mide los tiempos de acceso a medicamentos innovadores en Latinoamérica
- Noticia

La Federación Latinoamericana de la Industria Farmacéutica (FIFARMA) lanzó la segunda versión del W.A.I.T. (Waiting to Access Innovative Therapies) Indicator 2023 para Latinoamérica. Este estudio analiza el tiempo que esperan los pacientes latinoamericanos para acceder a medicamentos innovadores contra el cáncer y las enfermedades huérfanas. La presentación de sus resultados fue liderada por Yaneth Gina, Directora Ejecutiva de FIFARMA y André Ballalai, Líder de Acceso para Latinoamérica de IQVIA y se realizó el panel “Acceso a la Innovación en LATAM: Patient W.A.I.T Indicator 2023” moderado por la Gerente de Innovación y Salud de la Cámara de la Innovación Farmacéutica, Francisca Rodríguez y que contó con la participación de Aline Silva, Investigadora de la Universidad de Columbia Británica y Universidad de Brasilia y Diego Guarín, Presidente del capítulo de ISPOR -Sociedad Profesional de Investigación de Resultados y Economía de la Salud, por sus siglas en inglés-.
Este proyecto se inspira en una iniciativa europea realizada por IQVIA para la Federación Europea de Industrias y Asociaciones Farmacéuticas (EFPIA) desde 2004.
El estudio analiza los tiempos de disponibilidad y aprobación de 228 tratamientos innovadores desde que son aprobados por las agencias regulatorias de Estados Unidos (FDA) y la Unión Europea (EMA) hasta que están disponibles en algún esquema de cobertura para los pacientes en 8 países latinoamericanos: Argentina, Brasil, Chile, Colombia, Costa Rica, Ecuador, México y Perú.
El FIFARMA W.A.I.T Indicator destaca las inequidades en el acceso de los pacientes latinoamericanos a los medicamentos, revelando que el tiempo promedio de espera desde la aprobación de la FDA hasta la disponibilidad en algún esquema de cobertura, oscila entre 1,9 y más de 4,5 años. Actualmente, se estima que un tratamiento innovador contra el cáncer que recibe aprobación regulatoria en Estados Unidos en el mes de febrero de 2024, por ejemplo, podría estar cubierto para los pacientes latinoamericanos en el segundo semestre de 2028.
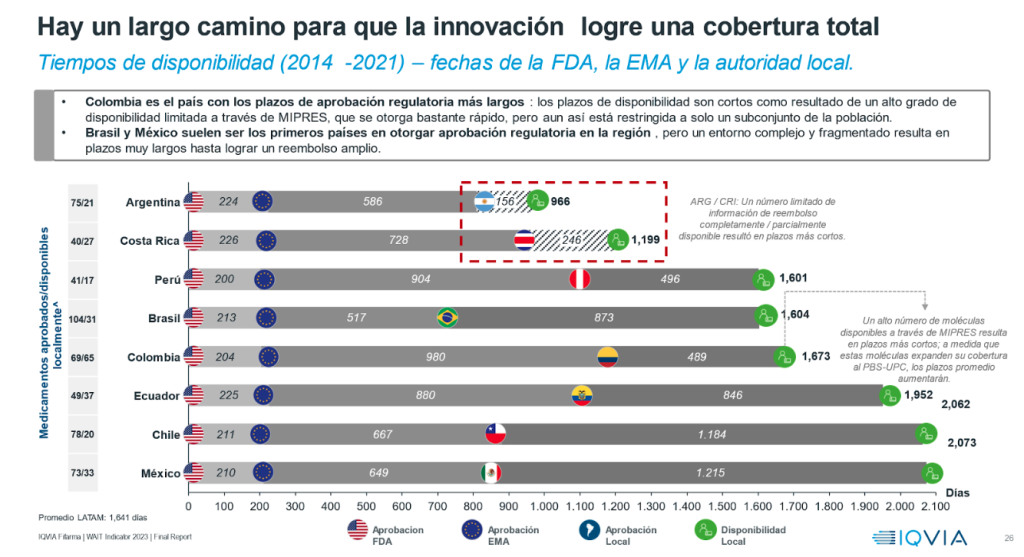
Adicionalmente, el estudio muestra que de los 228 medicamentos aprobados por la EMA y la FDA, solo 130 tienen aprobación regulatoria en algún país de América Latina y de éstos solo 86 están disponibles ampliamente en al menos uno de los mercados analizados.
Andre Ballalai, líder de acceso para IQVIA Latam afirmó: “El estudio revela que Colombia es el país con los plazos de aprobación regulatoria más largos. Asimismo, se evidencia que Brasil y México suelen ser los primeros países en otorgar aprobación regulatoria en la región, pero el entorno complejo y fragmentado resulta en plazos muy largos hasta lograr un amplio reembolso”. Respecto de la situación de Chile, Ballalai señaló que “es llamativo que en lo relacionado a los medicamentos oncológicos, los tiempos de cobertura son mayores que en el resto de Latinoamérica, a diferencia de lo que sucede en tratamientos para enfermedades raras, donde se nota la acción de la Ley Ricarte Soto, obteniendo mejores resultados en términos de cobertura”.
Yaneth Giha, Directora Ejecutiva de FIFARMA, comentó: “Nuestra meta es lograr que los pacientes latinoamericanos accedan de manera amplia y equitativa a medicamentos innovadores. El informe resalta la importancia de la colaboración entre la industria farmacéutica, agencias gubernamentales, distribuidores, médicos y asociaciones de pacientes para mejorar el acceso a tratamientos. Juntos, podemos ofrecer esperanza a millones y asegurar que la innovación en salud beneficie a todos por igual”.
Este informe destaca los retrasos que enfrentan los pacientes en Latinoamérica al intentar acceder a tratamientos innovadores para cáncer y enfermedades raras. Cabe señalar que el estudio no profundiza en las razones detrás de estos retrasos. Este es un punto de inicio para motivar la colaboración entre los distintos participantes del sistema de salud regional, con el fin de identificar y abordar las causas de estos retrasos, mejorando así el acceso de los pacientes a las últimas innovaciones médicas y científicas.
Para acceder a la presentación y panel revisa a continuación: